Colorectale levermetastasen
De aanbevelingen in deze module zijn overgenomen uit de 2014 richtlijn en in 2019 door de werkgroep beoordeeld als actueel.
Resectie
Partiële leverresectie is de gouden standaard voor colorectale levermetastasen. Resectie van colorectale levermetastasen leidt in geselecteerde patiëntengroepen tot een 5-jaars overleving van 25% – 60%. Als gevolg van lokale irresectabiliteit, extrahepatische uitbreiding of door aanwezige comorbiditeit komt slechts tot 30% van de patiënten in aanmerking voor een in opzet curatieve resectie. Er zijn aanwijzingen dat bij normaal leverparenchym maximaal 80% van het levervolume kan worden verwijderd met beperkt gevaar op postoperatief leverfalen.
Resectie van colorectale levermetastasen leidt in de meer recente studies bij geselecteerde patiëntengroepen tot een 5-jaars overleving van 30% tot 60%, echter slechts 15-30% van de patiënten met levermetastasen zijn uiteindelijk resectabel met curatieve intentie (21). Er zijn geen klinische studies die patiënten randomiseren tussen resectie en systemische chemotherapie. Er zijn ook geen prospectieve studies uitgevoerd waarbij patiënten met een beperkt aantal en resectabele colorectale levermetastasen behandeld zijn met moderne systemische therapie. Voor patiënten met uitgebreide colorectale levermetastasen zijn er een tweetal case-control series beschreven. De grootste serie is van Broquet (2011). Deze vergelijkt 2 groepen patiënten met dezelfde patiënten karakteristieken behandeld met alleen systemische chemotherapie (n=62, groep 1) versus systemische chemotherapie gevolgd door resectie (n=65, groep 2). In groep 1 werden alleen patiënten geïncludeerd die respondeerden op systemische chemotherapie. Beide groepen hadden mediaan 6 colorectale levermetastasen (range 2-18) en waren verder ook vergelijkbaar op alle andere karakteristieken. Groep 2 had een langere overleving (5-jaars overleving 15% vs. 51%)
Ook Kopetz liet een vergelijkbaar resultaat zien in hun retrospectieve serie van patiënten die een resectie hebben ondergaan versus alleen systemische therapie (23). Er is dus geen bewijs van hoog niveau dat lokale therapie een langere overleving oplevert ten opzichte van systemische therapie. De overleving na partiële leverresectie is dermate overtuigend ten opzichte van het resultaat van systemische behandelingen dat dit de behandeling van voorkeur is.
Criteria voor resectabiliteit
- Bij normaal leverparenchym en indien er geen sprake is van neoadjuvante systemische therapie, dient minimaal 20 procent van de lever over te blijven na resectie (=rest volume);
- Indien er primair onvoldoende leverparenchym zou overblijven na resectie zou inductie systemische therapie en/of vena-porta embolisatie en/of “two-stage†resecties moeten worden overwogen;
- Geen absolute contra-indicaties zijn; bilobaire levermetastasen, aantal metastasen, grootte van de metastasen, wel of niet synchroniciteit, extra-hepatische metastasen, stadium primaire tumor, leeftijd en waarde van het serum CEA;
- Geen contra-indicatie is een te verwachten krappe resectiemarge. In centra met veel expertise is er de mogelijkheid om resecties uit te voeren direct grenzend aan grote vaat- en/of galwegstructuren met kleinere marges. Omdat het echter moeilijk is op voorhand de marge te bepalen, wordt een ruime marge van 10 mm geadviseerd.
Gezien de eventuele toepassing van effectieve systemische chemotherapie, de verbeterde technieken en toegenomen mogelijkheden van lokale therapieën voor patiënten met colorectale levermetastasen en de toegenomen mogelijkheden voor behandeling van het eventuele recidief, zijn de ‘klassieke prognostische factoren’ niet meer van toepassing (11; 31).
Voldoende rest- leverweefsel na resectie
De mogelijkheid om resectie van een groot deel van het levervolume uit te voeren, zonder risico op postoperatieve insufficiëntie van de restlever, wordt mede bepaald door de kwaliteit van het parenchym. Bij normaal leverparenchym kan maximaal tot 80% van het levervolume worden verwijderd met gering gevaar op postoperatief leverfalen (13; 22; 24; 32; 1). Bij aangedaan leverweefsel na systemische therapie en/of cirrose wordt dit percentage kleiner (1). De normale lever heeft een aanzienlijk vermogen tot regeneratie waardoor de levercapaciteit postoperatief zal toenemen. Echter als het te reseceren deel meer dan 80 procent van het functionerend leverweefsel betreft worden de morbiditeit en mortaliteit duidelijk hoger als gevolg van postoperatieve leverinsufficiëntie. Dit houdt in dat als er uitgebreide resecties worden overwogen waarbij slechts 20% van de lever overblijft na resectie, er een combinatiebehandeling moet worden overwogen. Bij diffuse parenchymafwijkingen, zoals bij cirrose of uitgebreide steatose, is het maximaal te verwijderen volume echter veel beperkter (32). Ook het vermogen tot leverregeneratie en daarmee de mogelijkheid tot herstel van leverfunctie, is veel kleiner.
Een van de mogelijkheden om de toekomstige restleverfunctie te vergroten is het uitvoeren van een preoperatieve selectieve vena portae embolisatie aan de aangedane zijde. Hierdoor wordt hypertrofie geïnduceerd in het contralaterale deel van de lever zodat deze een grotere functionele capaciteit krijgt en de resectie veiliger kan worden verricht. Een van de problemen is dat niet altijd het effect van deze procedure voorspeld kan worden en dat metingen van de werkelijke leverfunctie lastig zijn.
Volumetrie van de lever
Het meten van het volume van de toekomstige lever na resectie gebeurt door middel van volumetrie van de al verkregen diagnostische spiraal CT of MRI data. De minimale grootte van de restlever ten opzichte van het totale volume van een gezonde lever dient 20% te zijn om een veilige leverresectie uit te voeren bij patiënten die niet zijn voorbehandeld met systemische therapie en/of levercirrose. Dit komt ongeveer overeen met een resectie van minder dan 6 leversegmenten. Voor patiënten met een chronische ziekte geldt hiervoor een grens van 50%-60% ofwel 4-5 segmenten. Het volume van de lever correleert echter niet altijd goed met de werkelijke functie van de lever. Er zijn een tweetal technieken om de leverfunctie te bepalen: Indocyaninegroen (ICG)-test en hepatobiliaire scintigrafie. Met zowel de ICG-klaringstest als hepatobiliaire scintigrafie meet men uiteraard de functie van de gehele lever. Er bestaat echter tot op heden geen manier om de functie van de toekomstige restlever te bepalen.
Met betrekking tot de kans op het optreden van postoperatieve leverinsufficiëntie en de complicaties die daarvan het gevolg zijn wordt een voorspelling gedaan op basis van de volgende gegevens:
- de geschatte functie van de lever,
- het volume van de toekomstige restlever,
- de aan- en afwezigheid van steatose of fibrose,
- de algemene toestand van de patiënt.
De resultaten van re-chirurgie indien het tijdsinterval van hernieuwde metastasen <6 maanden is, lijken slechter dan indien het tijdsinterval >6 maanden is.
Chirurgische anatomie van de lever
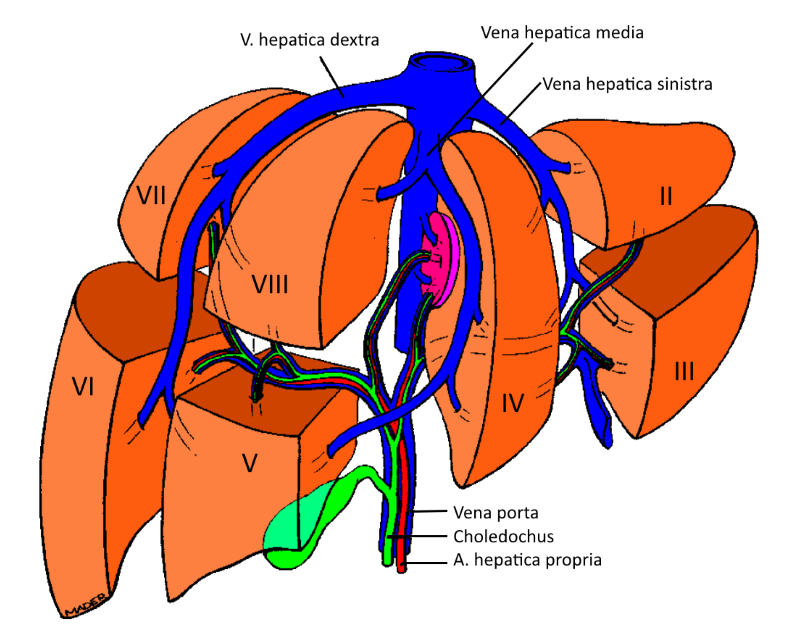
De functionele, anatomische indeling van de lever in acht segmenten (I-VIII) door de Franse chirurg Couinaud betekende een belangrijke stap voorwaarts in de ontwikkeling van de leverchirurgie. Ieder segment vormt een functionele eenheid met gescheiden arteriële en portale aanvoerende vaten en een eigen galweg. De drie levervenen (respectievelijk de rechter en linker levervenen, en de centrale levervene) verdelen de lever in vier sagittale sectoren en draineren in de suprahepatisch gelegen vena cava. Het vlak tussen de twee middelste sectoren vormt de anatomische scheiding tussen rechter en linker leversegmenten (het anatomische midden van de lever) en wordt bepaald door de centrale levervene.
Soorten partiële leverresectie
Een type resectie wordt benoemd naar de segmenten die bij de resectie worden verwijderd. De klassieke, anatomische resecties zijn de rechtszijdige en linkszijdige hemihepatectomie waarbij respectievelijk, de segmenten 5, 6, 7 en 8 of de segmenten 2, 3 en 4 worden gereseceerd. Deze resecties kunnen worden uitgebreid door van de contralaterale zijde, één of twee segmenten extra te reseceren: een uitgebreide (extended) hemihepatectomie rechts omvat dan excisie van de segmenten 5, 6, 7, 8 en 4 (in de Engelstalige literatuur ook wel trisegmentectomy genoemd) terwijl een uitgebreide (extended) hemihepatectomie links excisie van de segmenten 1, 2, 3, 4 en daarbij nog de segmenten 5 en 8 betekent.
Kleinere resecties zijn de bisegmentectomieën zoals een segment 2/3 resectie of segment 6/7 resectie, meestal voor perifeer gelegen tumoren. De keuze van een resectie wordt bepaald door de locatie, aantal en grootte van de tumor(en) als ook de nabijheid van belangrijke vasculaire structuren. Over het algemeen wordt gestreefd naar zo klein mogelijk resecties, met behoud van zoveel mogelijk parenchym. Indien mogelijk zal men segmentele resecties uitvoeren of zelfs een deel van een segment (subsegmentele resectie). Oppervlakkige gelegen tumoren kunnen lokaal worden gereseceerd (wigexcisie).
Er blijkt geen verschil in overleving te zijn tussen anatomische en niet-anatomische resecties, waarbij het resectievlak door een segment loopt. Bovendien is de morbiditeit en mortaliteit niet hoger in de niet-anatomische groep.
Complicaties na leverresectie
De meest voorkomende complicaties na leverresecties zijn bloedverlies, gallekkage, sepsis en insufficiëntie van de restlever. Vooral de mate van bloedverlies tijdens de operatie en het aantal verwijderde segmenten zijn gecorreleerd met het optreden van complicaties na de ingreep. Veel van de maatregelen die worden toegepast bij leverresecties zijn dan ook gericht op het zoveel mogelijk beperken van het bloedverlies. Overmatig bloedverlies tijdens partiële leverresecties kan worden beperkt door:
- Tijdelijke occlusie van de afferente bloedvaten naar de lever. De Pringle-manoeuvre waarbij zowel de vena portae als de arteria hepatica worden afgeklemd is de klassieke methode om bloedtoevoer naar de lever tijdelijk uit te schakelen. Er zijn twee manieren om dit uit te voeren: intermitterend afklemmen en continue afklemmen.
- Volledige vasculaire exclusie van de lever. Bij resecties waar ook een deel van de vena cava dient te worden verwijderd, kan totale vasculaire exclusie van de lever worden toegepast waarbij naast de Pringle-manoeuvre, ook de vena cava craniaal en caudaal van de lever wordt afgeklemd.
- Het laag houden van de centraal veneuze druk (<4 cm Hg) beperkt het retrograad bloedverlies uit de levervenen en het capillaire bed. Onder deze omstandigheden kunnen de meeste leverresecties zonder groot bloedverlies worden uitgevoerd.
Het toepassen van technieken voor dissectie van het leverparenchym. Voor de parenchymale dissectie kunnen verschillende technieken worden gebruikt om met zo min mogelijk bloedverlies het parenchym te klieven. Er lijkt geen verschil te zijn in uitkomst, tussen de verschillende technieken van parenchymdissectie. Een veel toegepaste methode is de CUSA (Cavitron Ultrasonic Surgical Aspirator) waarbij het parenchym selectief wordt verwijderd zodat kleine bloedvaten en galtakken kunnen worden afgebonden. Het toepassen van hemostatische middelen aan het einde van de operatie lijkt geen invloed te hebben op post operatieve complicaties. Twee RCT’s lieten geen verschil zien in het optreden van post-operatieve resectievlak gerelateerde complicaties [Fiqueras 2007] (40).
Tumorvrije marge na resectie metastasen
Over het algemeen wordt een marge van minimaal 10 mm gehanteerd, echter door de technische ontwikkelingen, de ontwikkelingen van de systemische therapie en ervaring van chirurgen is het mogelijk om bij marges van kleiner dan 10 mm te reseceren zonder vitale structuren (vaat/galweg) te bedreigen. Er is geen eenduidige literatuur over de grootte van de marge (retrospectieve series). In het algemeen kan men zeggen dat 1 mm voldoende is bij een gelijke overleving ten opzichte van grotere marges (9). In het tijdperk van moderne/effectieve chemotherapie lijkt een marge van 0 mm te voldoen, afhankelijk van de respons op de chemotherapie (9; 7).
Re-resecties
Indien patiënten eerder een leverresectie hebben ondergaan en opnieuw levermetastasen ontwikkelen bestaat er een optie voor chirurgische behandeling. Uit series waarin, na zorgvuldige selectie van patiënten (voldoende rest leverparenchym, voldoende tumorvrije marge, afwezigheid van extrahepatische ziekte en klinische toestand van de patiënt) reresectie werd uitgevoerd, bleek dit een veilige procedure met goede lange termijn resultaten, conform de uitkomst van de resectie (6; 4; 16; 19; 28; 29; 30). Ook de mortaliteit en morbiditeit van reresectie blijken beperkt (42). De resultaten van re-chirurgie als het tijdsinterval van hernieuwde metastasen <6 maanden is, lijken slechter dan wanneer het tijdsinterval >6 maanden is (37).
Two stage resections
Patiënten die irresectabele afwijkingen hebben, vanwege bilobaire distributie van tumoren, kunnen in aanmerking komen voor second-stage resectie. Second-stage resectie houdt in complete resectie van de tumor in een helft van de lever, gevolgd door in tweede instantie resectie van de tumor in de contralaterale helft. De bedoeling is om het risico op leverfalen te reduceren door het uitvoeren van een tweede complete resectie nadat regeneratie is opgetreden. Dit kan gecombineerd worden met vena portae embolisatie en/of systemische therapie (18). In combinatie met portae embolisatie wordt in eerste instantie kleine laesies uit de toekomstige restlever verwijderd en in tweede instantie de vena portae embolisatie en resectie worden toegepast (5; 20). Broquet (2011) vergelijkt 2 groepen patiënten, met dezelfde patiënten karakteristieken behandeld, met alleen systemische chemotherapie (n=62, groep 1) versus systemische chemotherapie gevolgd door second stage resectie (n=65, groep 2). In groep 1 werden alleen patiënten geïncludeerd die respondeerden op systemische chemotherapie. Beide groepen hadden mediaan 6 colorectale levermetastasen (range 2-18) en waren verder ook vergelijkbaar op alle andere karakteristieken. Groep 2 had een evidente langere overleving (5-jaars overleving 15% vs. 51%).
Radio Frequentie Ablatie (RFA) en Microwave ablatie (MWA)
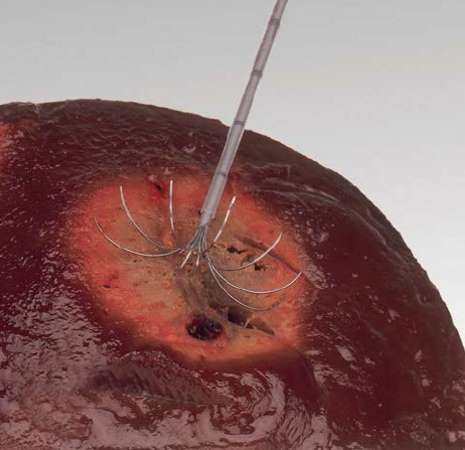
Bij patiënten die minder geschikt zijn voor chirurgische resectie door hoge leeftijd, comorbiditeit, ongunstige locatie van de laesie voor resectie, of waar een geschiedenis is van uitgebreide abdominale chirurgie kan bij beperkte tumorload in de lever en afwezigheid van of bij stabiele extra-hepatische ziekte ablatie in de vorm van (percutane) RFA een goede lokale behandelingsoptie zijn met goede klinische uitkomsten. Door chirurgische resectie te combineren met RFA kan het aantal resecties van levermetastasen toenemen.
RFA
Principe van de techniek
RFA is een techniek die gebruik maakt van lokale applicatie van hitte door middel van hoogfrequente wisselstroom. Met deze techniek wordt weefsel verhit tot een temperatuur boven de 50°C, waardoor denaturatie van intracellulaire eiwitten en vernietiging van celmembranen (coagulatie necrose) optreedt (35; 13; 48). De tumor wordt aangeprikt met een naald (open buik, laparoscopisch of percutaan). Het aanprikken van de tumor gebeurt meestal echografisch, maar zo nodig met CT. De naald is een gedeeltelijke geïsoleerde schacht (14-17,5 gauge diameter) met een niet-geïsoleerde distale tip. Er zijn verschillende typen RFA-naalden verkrijgbaar. Zodra de naald correct is gepositioneerd wordt de RFA-procedure gestart waarbij hoogfrequente wisselstroom, vanuit de tip, het omliggende weefsel instromen. Hierdoor vindt de applicatie plaats van thermale energie, totdat een adequate temperatuur wordt bereikt.
Complicaties
Een uitgebreide review van Mulier, waarin 82 artikelen met 3.670 patiënten vanaf 1990 tot 2002 werden geëvalueerd, meldde een morbiditeit van 8,9% en mortaliteit van 0,5% (38). Een systematische review van Decadt, waarin 44 artikelen met 1.931 patiënten vanaf 1995 tot 2003 werden geëvalueerd, meldde vergelijkbare resultaten: morbiditeit in 137 (7,1%) en mortaliteit in 10 patiënten (0,5%) (14).
Er blijken bij RFA significant minder complicaties op te treden dan bij chirurgische resectie (3,9 vs. 18,3%) en een significant kortere opnameduur (3,9 vs. 9,2 dagen).
Lokale controle en overleving
Lokale controle is volgens Solbiati beter te bereiken bij tumoren kleiner dan 3 cm (48). Een andere studie van Solbiati vermeldt ook dat het recidiefpercentage hoger is bij grote laesies (21% bij laesies =2,5 cm, 52,8% bij laesies van 2,6- 4,0 cm en 68,4% bij laesies =4 cm) (50). Dit blijkt ook uit een uitgevoerd prospectieve studie, waarin Berber (2005) een mediane overleving van 38, 32 en 21 maanden voor laesies <3 cm, 3-5 cm en >5 cm rapporteerde.
De meeste studies rapporteren kleine patiëntengroepen [(18; 39; 1; 58) of het betreft studies met gecombineerde data van primaire levertumoren en metastasen van verschillende origine (12; 30; 8; 47; 33; 25). Er zijn een aantal publicaties met lange termijn gegevens over overleving van grote groepen patiënten met colorectale levermetastasen die behandeld zijn met RFA, echter geen gerandomiseerde trials.
In een prospectieve studie van Solbiati, werden 117 patiënten (179 metastasen variërend van 0,6 tot 9,6 cm) gevolgd die met RFA voor metachrone colorectale levermetastasen werden behandeld (48). Eventuele lokale recidieven werden opnieuw met RFA behandeld. In deze studie werd een 1-, 2- en 3-jaars overleving gemeld van respectievelijk 93%, 69% en 46% en een mediane overleving van 36 maanden. Dezelfde auteurs hebben hun data geüpdatet (166 patiënten met 378 metastasen) met een 1, 2, 3, 4 en 5-jaars overleving van respectievelijk 96%, 64%, 45%, 36% en 22% (49; 32) met 423 patiënten en 615 metastasen, variërend van 0,5 tot 5,0 cm, rapporteerde 1, 2, 3, 4 en 5-jaars overleving van 86%, 63%, 47%, 29% en 24% respectievelijk. Ook Gillams liet vergelijkbare resultaten zien met een 1, 3 en 5-jaars van 91%, 40% en 17% en een mediane overleving van 32 maanden in 167 patiënten behandeld (17).
In een Cochrane review werden 18 studies bekeken waarbij RFA werd vergeleken met andere behandelingsopties bij resectabele en niet-resectabele levermetastasen. Hierbij was er slechts 1 prospectief gerandomiseerde studie waarbij RFA gecombineerd met systemische chemotherapie werd vergeleken met alleen chemotherapie bij 119 patiënten met niet-resectabele levermetastasen. In deze studie vond men een significant betere progressievrije overleving bij 3 jaar van 27,6% voor de combinatie behandeling t.o.v. 10,6% voor chemotherapie alleen (HR 0,60; 95%BI: 0,42-0,95). De 30 maanden OS van 61,7% (95%BI: 48,2-73,9) voor de combinatiebehandeling verschilde echter niet significant met die van chemotherapie alleen (57,6%, 95%BI: 44,1-70,4).
Bij 17 studies was geen sprake van randomisatie, met een sterk verhoogd risico op selectie bias en onvergelijkbaarheid door verschillende inclusiecriteria van de diverse studies. Lokale ablatie wordt in de klinische praktijk veelal toegepast bij patiënten die minder geschikt zijn voor chirurgische resectie, wat kan resulteren in slechtere uitkomsten. In klinieken met een succesvol RFA-programma wordt bij patiënten met een hoger risico vaak voor een minder invasieve behandeling gekozen, zoals RFA, met een striktere selectie voor chirurgische resectie en betere resultaten tot gevolg.
Circa 20% van de patiënten met colorectale levermetastasen komt in aanmerking voor chirurgische resectie. In de literatuur is geen bewijs dat RFA de chirurgische resectie van colorectale levermetastasen kan vervangen. Chirurgische resectie blijft de gouden standaard bij resectabele ziekte (9; 14; 36; 5; 19) [Laz 2004]. Door hoge leeftijd, comorbiditeit, ongunstige locatie of een geschiedenis van uitgebreide abdominale chirurgie kunnen patiënten minder geschikt zijn voor een leverresectie (10; 23; 27; 31). Bij dergelijke patiënten kan bij beperkte tumorload in de lever en afwezigheid van of stabiele extra-hepatische ziekte ablatie, de vorm van RFA een goede lokale behandelingsoptie zijn met goede klinische uitkomsten (10; 37; 43; 44; 31).
De mogelijkheden van uitgebreidere leverchirurgie nemen toe met de zich verder ontwikkelende chirurgische technieken. RFA kan gebruikt worden als complementaire tool bij resectie van levermetastasen, om meer patiënten chirurgische therapie te kunnen bieden (45; 55; 59). Waar voorheen lokalisatie van metastasen in zowel de linker als rechter leverkwab een contra-indicatie was voor chirurgische resectie kan een patiënt nu, met een (extended) hemihepatectomie en een RFA wel lokaal worden behandeld.
MWA
Principe van de techniek
Een meer recente ontwikkeling in de thermische ablatietechnieken is de Microwave (MW) ablatie. De techniek is vergelijkbaar met RFA maar maakt gebruik van microgolven (0,9-2,4 GHz). De probe wordt op vergelijkbare wijze als bij RFA in de tumor geplaatst, maar het gebruik van grounding pads is niet nodig. Oscillatie van watermoleculen leidt door wrijving tot lokale verhitting en celdood. MW ablatie heeft een theoretisch voordeel ten opzichte van RFA. Een snellere en effectievere verhitting maakt de techniek minder gevoelig voor het heatsink effect nabij grotere bloedvaten, waardoor een betere ablatie plaats kan vinden nabij deze structuren. Daarnaast is de techniek minder gevoelig voor lokale verdroging en verkoling van het weefsel (40; 22).
Complicaties
Livraghi rapporteerde de complicaties van MW ablatie bij 736 patiënten met 1.037 laesies. Zij concludeerden dat MW ablatie van de lever veilig is met 2,9% majeure complicaties en 7,3% mineure complicaties (23).
Lokale controle en overleving
In een kleine gerandomiseerde prospectieve studie werd MW ablatie vergeleken met chirurgische resectie bij patiënten met resectabele colorectale levermetastasen. Voor de MW groep van 14 patiënten was de 1, 2 en 3-jaars overleving 71%, 57% en 14% met een mediane overleving van 25 maanden. Bij de resectiegroup was dit 69%, 56%, 23% en 23 maanden. In een systematische review werden 13 studies geïncludeerd. De 1, 3 en 5 jaar overleving was 40%-92%, 0%-57% en 14%-32% met een mediane overleving van 21-43 maanden en een lokaal recidief percentage van 2%-13% (58).
Geïsoleerde leverperfusie
De geïsoleerde leverperfusie is ontwikkeld ten tijde van de relatief ineffectieve ‘oude’ systemische chemotherapie, die een laag responspercentage gaf bij patiënten met een gemetastaseerd colorectaal carcinoom (55). De huidige systemische therapie is veel effectiever in vergelijking met historische chemotherapie, met dezelfde respons percentages als de geïsoleerde leverperfusie (52). Mede gezien de belasting voor de patiënt, wordt daarom de geïsoleerde leverperfusie voor patiënten met colorectale levermetastasen zelden tot nooit meer toegepast.
Trans Arteriële Chemo Embolisatie (TACE)
TACE voor colorectale levermetastasen moet (nog) gezien worden als experimentele behandeling en dient in studieverband te worden verricht.
De rol van TACE bij patiënten met niet-resectabele colorectale levermetastasen in vergelijking met andere lokale behandeltechnieken of systemische behandeling moet adequaat onderzocht worden in gerandomiseerde studies. Op dit moment zijn er geen data die de voor– en nadelen van TACE hebben vergeleken met andere, lokale niet-chirurgische technieken en er is te weinig evidence om TACE toe te passen indien er nog systemische behandelingsopties zijn.
Trans Arteriële Chemo Embolisatie (TACE) is een methode waarbij men de colorectale levermetastase probeert te vernietigen door zowel de bloedtoevoer naar de metastase af te sluiten, als door zeer lokaal in de tumor chemotherapie te geven. Dit gebeurt door chemotherapeutica zeer selectief toe te dienen in de arterie of meerdere arteriën die de metastase(n) van bloed voorziet/voorzien. Recent is hier de TACE DEBIRI bijgekomen; dit is een TACE met zogenaamde ‘drug eluting beads of irinotecan’. Tegelijkertijd vindt embolisatie plaats van desbetreffende arterie/arteriën. Hierdoor ontstaat enerzijds een verminderde aanvoer van zuurstof en voeding voor de metastase waardoor de tumorcellen beschadigd raken. Anderzijds vindt er een grotere opname plaats van het chemotherapeuticum door de vertraagde bloedstroom en de hogere directe concentratie. Het effect van de chemotherapie neemt hierdoor toe. In Nederland doet de interventie radioloog dit op een percutane manier.
De literatuur van TACE voor patiënten met colorectale levermetastasen is zeer beperkt. Tot 2013 zijn er 6 case series beschreven en 1 fase 3 trial. De studie van Florentini, randomiseerde 75 patiënten tussen chemo-embolisatie met irinotecan eluting beads (DEBIRI) of FOLFIRI (16). Na 50 maanden was de algehele overleving significant beter in de groep van patiënten die behandeld waren met DEBIRI ten opzichte van de patiënten die behandeld waren met FOLFIRI (p=0,031) HR 0,60 (95%BI: 0,37-0,97). De mediane overleving was 22 maanden (95%BI: 21-23), voor DEBIRI en 15 maanden (95%BI: 12-18) voor de FOLFIRI groep. Belangrijkste tekortkoming van de studie was de onduidelijke randomisatie en daardoor de mogelijkheid van een ingeslopen bias.
Stereotactische radiotherapie (SBRT)
De rol van stereotactische radiotherapie in vergelijking met andere lokale behandeltechnieken als RFA moet onderzocht worden in gerandomiseerde studies.
Op dit moment zijn er geen data die de voor– en nadelen van SRT hebben vergeleken met andere, lokale niet-chirurgische technieken.
Bij stereotactische radiotherapie (SRT) wordt hoge bestralingsdoses gegeven met hoge precisie in een klein aantal fracties. Er zijn geen strikte criteria qua aantal metastasen en maximale tumordiameter voor SRT. Kandidaten voor een ablatieve behandeling met SRT zijn over het algemeen patiënten met één tot vier metastasen, met een maximale tumordiameter van 5 tot 6 cm, in redelijk goede conditie en indien extra-hepatische ziekte aanwezig is moet deze potentieel behandeld kunnen worden (10; 5; 19; 27; 37; 43; 44; 55; 59; 22; 24; 28; 29; 50). Patiënten die in aanmerking komen voor SRT hebben irresectabele levermetastasen en vaak liggen deze ongunstig voor radiofrequentie ablatie (RFA).
De lokale controle bij 1 en 2 jaar na SRT in gepubliceerde series met alleen colorectale levermetastasen varieerde tussen 67%-100% en 55%-78% (24; 29; 51; 12; 54)*. De overleving bij 1 en 2 jaar varieerde tussen 53-100% en 38-83% (29; 51; 12; 54). De gerapporteerde mediane overleving lag tussen 25 en 34 maanden in twee gepubliceerde series (29; 54). Toxiciteit gerelateerd aan de behandeling met SRT voor levermetastasen is over het algemeen beperkt. Verhoogde geïsoleerde leverenzymen, misselijkheid, vermoeidheid, gastritis en huidtoxiciteit zijn gerapporteerd (19; 31; 44; 54; 24; 54).
Een prospectieve studie heeft de impact geanalyseerd van SRT op de kwaliteit van leven van 28 patiënten met levertumoren, vooral patiënten met levermetastasen (60). Gemiddelde waarden van QoL-5D (EQ-5D) index, EQ-VAS score en EORTC-QLQ C-30 global health status namen toe na de behandeling maar er was geen significant verschil tussen de waarden voor de behandeling en één, drie en zes maanden daarna.
*) Met betrekking tot Hoyer 2006; personal communication over data betreffend lokale controle van levermetastasen op 2 jaar was 78%.
Intra-arteriële Yttrium-90-radio-embolisatie (90Y-RE)
Intra-arteriële Yttrium-90 radio-embolisatie (90Y-RE) is een nieuwe behandeling voor salvage patiënten met colorectale levermetastasen (CRCLM). Het gaat hierbij om patiënten waarbij de uitzaaiingen beperkt zijn tot de lever, de primaire tumor verwijderd is en patiënt progressief is na standaard chemotherapie lijnen (oxaliplatin en irinotecan). Studies waarin CRCLM patiënten in salvage setting worden behandeld met radio-embolisatie rapporteren een mediane overleving van 10,0 maanden
Intra-arteriële Yttrium-90 radio-embolisatie (90Y-RE) is een nieuwe behandeling voor salvage patiënten met colorectale levermetastasen (CRCLM). Het gaat hierbij om patiënten waarbij de uitzaaiingen beperkt zijn tot de lever, de primaire tumor verwijderd is en patiënt progressief is na standaard chemotherapie lijnen (oxaliplatin en irinotecan). Studies waarin CRCLM patiënten in salvage setting worden behandeld met radio-embolisatie rapporteren een mediane overleving van 10,0 maanden (21). De potentiële voordelen van de behandeling met 90Y-RE ten opzichte van best-supportive care, voor de uitkomstenmaat totale overleving zijn onderzocht in 3 gerandomiseerde studies (20; 21; 53). Er zijn geen resultaten uit RCT’s beschikbaar die 90Y vergelijken met 1e of 2e lijn chemotherapie. Een dergelijk studie is momenteel wel gaande2. De potentiële voordelen van de behandeling met 90Y-RE ten opzichte van best-supportive care, voor de uitkomstenmaat totale overleving zijn onderzocht in 3 gerandomiseerde studies (20; 21; 53). Er zijn geen resultaten uit RCT’s beschikbaar die 90Y vergelijken met 1e of 2e lijn chemotherapie. Een dergelijk studie is momenteel wel gaande.
Vena portae embolisatie
Mortaliteit en morbiditeit na leverresecties worden voor een belangrijk deel bepaald door de functie van het deel van de restlever. Een te kleine restlever kan leiden tot postoperatieve leverinsufficiëntie. Hierdoor kan de patiënt in een hepatisch coma raken en is de kans op overlijden groot (80%).
Vena portae embolisatie (VPE) is een methode met als doel het vergroten van het volume van de toekomstige restlever voordat de resectie plaatsvindt. De literatuur laat een gemiddelde stijging van het volume van de toekomstige restlever na embolisatie ten opzichte van de toekomstige restlever voor embolisatie van 37,9% (35). Voor patiënten met een normale leverfunctie is een periode van 2-4 weken voldoende om adequate hypertrofie te bereiken. Voor patiënten met een cirrotische lever of met diabetes mellitus geldt hiervoor een periode van 6-8 weken. Vooral cirrose heeft een negatieve invloed op de mate van hypertrofie. Dit geldt in mindere mate voor schade aan de lever door cholestase en chemotherapie (35). Het volume van de lever correleert echter niet altijd goed met de werkelijke functie van de lever. Er zijn tweetal technieken om de leverfunctie te bepalen: Indocyaninegroen (ICG)-test en hepatobiliaire scintigrafie. 99mTC-mebrofenin hepatobiliaire scintigrafie kan worden toegepast om het risico op postoperatief leverfalen in te schatten (15).
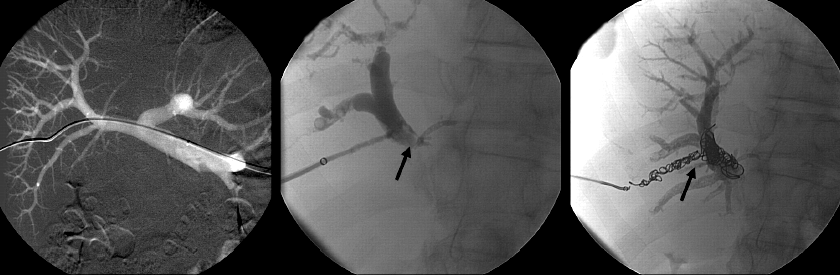
Op basis van gegevens over de geschatte functie van de lever en het volume van de toekomstige restlever, de aan- en afwezigheid van steatose of fibrose en de algemene toestand van de patiënt wordt een voorspelling gedaan met betrekking tot de kans op het optreden van postoperatieve leverinsufficiëntie en de complicaties die daarvan het gevolg zijn.
De meest toegepaste technieken die worden gebruikt om toegang tot de vena portae te verkrijgen zijn directe cannulatie van de vena ileocolica, de percutane toegangsweg en peroperatief chirurgisch als blijkt dat het te reseceren volume groter is dan preoperatief voorspeld. De percutane techniek kan zowel ipsilateraal als contralateraal worden toegepast en heeft als voordeel dat er geen laparotomie hoeft plaats te vinden met de bijbehorende risico’s. Deze techniek minimaliseert het risico van trombose van de vena portae hoofdstam en schade aan de contralaterale vasculatuur.
Er zijn verschillende middelen beschreven waarmee de embolisatie kan worden uitgevoerd zoals n-butyl cyanoacrylaat met ethiodide olie, gelfoam, polidocanol, fibrinelijm, coils, polyvinyl alcohol (PVA), microsferen, ethanol, Amplatzer plugs, of een combinatie van middelen. De optimale (combinatie) van embolisatiemateriaal voor porta-embolisatie is niet duidelijk. Bij tijdelijke (absorbeerbare) materialen bestaat de kans op rekanalisatie met minder hypertrofie als gevolg (36). N-butyl cyanoacrylaat heeft mogelijk het beste effect, echter in een recente meta-analyse werd geen statistisch verschil aangetoond tussen de verschillende embolisatiematerialen (35). De preoperatieve mortaliteit varieert van 0-6,5% voor patiënten zonder cirrose en 6-7% voor patiënten met cirrose. Bij minder dan 15% van de patiënten traden complicaties op. Dit percentage is gelijk aan of lager dan het percentage complicaties na partiële resectie zonder VPE.
Een mogelijk nadeel van VPE is dat na resectie, de regeneratieve capaciteit van de restlever is uitgeput en dat een relatief tekort niet meer kan worden gecompenseerd.
Vrij recent is er een nieuwe techniek beschreven waar het leverparenchym wordt doorgenomen en de vena portae wordt geligeerd, maar de leverkwab wordt niet direct gereseceerd (Associating liver partition and portal vein ligation for staged hepatectomy: ALPPS) (33). Dit gebeurde na mediaan 9 dagen waarbij er een volume toename werd gezien van de ‘rest-lever’ van 73%. Deze techniek moet gezien worden als experimenteel en heeft nog geen vaste plaats in de behandeling van patiënten met colorectale levermetastasen.
Inductie systemische therapie
Patiënten met primair irresectabele maar potentieel resectabele metastasen dienen behandeld te worden met inductie systemische therapie. Het doel is een zodanige tumorreductie te verkrijgen dat een radicale resectie alsnog mogelijk wordt. Kenmerken van deze inductiebehandeling zijn dat een schema met een zo groot mogelijke kans op een objectieve respons wordt gekozen, en dat de duur van de behandeling wordt beperkt ter voorkoming van chirurgische complicaties. Een resectie dient dus plaats te vinden zodra metastasen resectabel zijn geworden. De bevinding dat metastasen in complete radiologische remissie in de meeste gevallen nog vitale tumorcellen bevatten is een tweede argument om niet de maximale tumorrespons af te wachten (10). Op grond van huidige gegevens kan echter geen duidelijke voorkeur worden uitgesproken om lokalisatie van radiologisch niet meer aantoonbare metastasen chirurgisch te verwijderen dan wel intact te laten. Voor meer gedetailleerde bespreking van de keuze van systemische therapie wordt verwezen naar de betreffende module.
Extrahepatische tumorgroei (inclusief hilus lymfklieren)
Vele studies laten zien dat patiënten met extrahepatische afwijkingen een slechtere prognose hebben dan patiënten zonder extrahepatische afwijkingen (12). Meerdere studies laten echter ook zien, dat een lange termijn overleving behaald kan worden bij een selectie van de patiënten. Dit zijn retrospectieve series, waarbij specifieke lokalisaties zeer beperkte overlevingsgetallen laten zien na resectie (bijvoorbeeld bijniermetastasen, para-aortale of truncus coeliacus klieren). Een meta-analyse bij 1.152 patiënten met gelijktijdige extrahepatische metastasen, laat ook zien dat lange termijn overleving behaald kan worden na resectie van hepatische en extrahepatische metastasen (12). Als er metastasen in één extrahepatisch orgaan zijn, lijkt de overleving beter na resectie dan de overlevingsgetallen van patiënten die behandeld zijn met systemische therapie alleen. Indien er metastasen in meer dan één extrahepatisch orgaan zijn, is de toegevoegde waarde van resectie mogelijk zeer beperkt en lijkt de overleving gelijk aan alleen systemische therapie.
Synchrone vs. metachrone levermetastasen
Er zijn geen studies die overleving van patiënten met synchrone levermetastasen vergelijken met patiënten met metachrone levermetastasen in prospectieve setting, rekening houdend met andere factoren zoals: aantal, grootte, uni-of bilobaire locatie, etc. In diverse retrospectieve studies wordt een 5-jaarsoverleving gerapporteerd conform de overleving na resectie van metachrone levermetastasen, ook bij een lokaal uitgebreide primaire tumor (39; 26; 34). Synchroniciteit is daarom geen contra-indicatie is voor partiële leverresectie (27; 38; 17).
Verschillende reviews en meta-analyses zijn uitgevoerd ten aanzien van timing van resectie van synchrone levermetastasen (39; 26; 34). Opgemerkt moet worden dat het hier niet gaat om prospectieve of gerandomiseerde studies. De mogelijkheden zijn synchrone resectie van primaire tumor en metastasen of metachrone resectie waarbij de primaire tumor eerst wordt geopereerd en 2 tot 3 maanden later de metastasen.
De laatste jaren is er een opkomst van de ‘Liver first approach’ waarbij eerst de lever wordt geopereerd en 2 tot 3 maanden later de primaire tumor. De literatuur over de ‘Liver first approach’ is zeer beperkt, er is een meta-analyse verricht en is er één artikel gepubliceerd met de lange termijns overleving (25; 8; 41). Op basis van de reviews en meta-analyse is er geen absolute voorkeur uit te spreken voor één van deze drie benaderingen. Uit de literatuur is wel te concluderen dat de synchrone resectie wordt uitgevoerd bij patiënten met een beperkt aantal metastasen en een lokaal beperkte tumor. Dit omdat anders wordt verwacht dat morbiditeit en zelfs mortaliteit zal toenemen (3). Timing is afhankelijk van expertise van het centrum.
Referenties
- Abdalla EK, Vauthey JN, Ellis LM, et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metstases. Ann Surg. 2004 Jun;239(6):818-25.
- Adam R, Akpinar E, Johann M, et al. Place of cryosurgery in the treatment of malignant liver tumors. Ann Surg 1997;225:39-8.
- Adam R, Hagopian EJ, Linhares M, et al. A comparison of percutaneous cryosurgery and percutaneous radiofrequency for unresectable hepatic malignancies. Arch Surg. 2002 Dec;137(12):1332-9; discussion 1340.
- Alexander HR, Libutti SK, Bartlett DL, et al. A phase I-II study of isolated hepatic perfusion using melphalan with or without tumor necrosis factor for patients with ocular melanoma metastatic to liver. Clin Cancer Res 2000;6:3062-70.
- Ambrosino G, Polistina F, Costantin G, et al. Image-guided robotic stereotactic radiosurgery for unresectable liver metastases: preliminary results. Anticancer Res 2009 Aug;29(8):3381-4.
- Bartlett DL, Libutti SK, Figg WD, et al. Isolated hepatic perfusion for unresectable hepatic metastases from colorectal cancer. Surgery. 2001 Feb;129(2):176-87.
- Berber E, Pelley R, Siperstein AE. Predictors of Survival After Radiofrequency Thermal Ablation of Colorectal Cancer Metastases to the Liver: A Prospective Study. J Clin Oncol 2005;23:1358-1364.
- Bleicher RJ, Allegra DP, Nora DT, et al. Radiofrequency ablation in 447 complex unresectable liver tumors: lessons learned. Ann Surg Oncol 2003;10:52-8.
- Blomgren H, Lax I, Göranson H, et al. Radiosurgery for Tumors in the Body: Clinical Experience Using a New Method. Journal of Radiosurgery 1998;1(1):63-74.
- Blomgren H, Lax I, Naslund I, et al. Stereotactic high dose fraction radiation therapy of extracranial tumors using an accelerator. Clinical experience of the first thirty-one patients. Acta Oncol 1995;34(6):861-70.
- Cirocchi R, Trastulli S, Boselli C, et al. Radiofrequency ablation in the treatment of liver metastases from colorectal cancer. Cochrane Database Syst Rev. 2012 Jun 13;6:CD006317.
- Chang DT, Swaminath A, Kozak M, et al. Stereotactic body radiotherapy for colorectal liver metastases: a pooled analysis. Cancer 2011 Sep 1;117(17):4060-9.
- Curley SA, Izzo F, Delrio P, et al. Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg. 1999 Jul;230(1):1-8.
- Dawson LA, McGinn CJ, Normolle D, et al. Escalated focal liver radiation and concurrent hepatic artery fluorodeoxyuridine for unresectable intrahepatic malignancies. J Clin Oncol 2000 Jun;18(11):2210-8.
- Decadt B, Siriwardena AK. Radiofrequency ablation of liver tumours: systematic review. Lancet Oncol 2004;5:550-60.
- Fiorentini G, Aliberti C, Tilli M, et al. Intra-arterial infusion of irinotecan-loaded drug-eluting beads (DEBIRI) versus intravenous therapy (FOLFIRI) for hepatic metastases from colorectal cancer: final results of a phase III study. Anticancer Res. 2012 Apr;32(4):1387-95.
- Gillams AR, Lees WR. Radio-frequency ablation of colorectal liver metastases in 167 patients. Eur Radiol 2004;14:2261-7.
- Gillams AR, Lees WR. Survival after percutaneous, image-guided, thermal ablation of hepatic metastases from colorectal cancer. Dis Colon Rectum. 2000 May;43(5):656-61.
- Goodman KA, Wiegner EA, Maturen KE, et al. Dose-escalation study of single-fraction stereotactic body radiotherapy for liver malignancies. Int J Radiat Oncol Biol Phys 2010 Oct 1;78(2):486-93.
- Gray B, Van Hazel G, Hope M, et al. Randomised trial of SIR-Spheres plus chemotherapy vs. chemotherapy alone for treating patients with liver metastases from primary large bowel cancer. Ann Oncol. 2001 Dec;12(12):1711-20.
- Hendlisz A, Van den Eynde M, Peeters M, et al. Phase III trial comparing protracted intravenous fluorouracil infusion alone or with yttrium-90 resin microspheres radioembolization for liver-limited metastatic colorectal cancer refractory to standard chemotherapy. J Clin Oncol. 2010 Aug 10;28(23):3687-94. doi: 10.1200/JCO.2010.28.5643. Epub 2010 Jun 21.
- Herfarth KK, Debus J. Stereotactic radiation therapy for liver metastases. Chirurg 2005 Jun;76(6):564-9.
- Herfarth KK, Debus J, Lohr F, et al. Stereotactic single-dose radiation therapy of liver tumors: results of a phase I/II trial. J Clin Oncol 2001 Jan 1;19(1):164-70.
- Hoyer M, Roed H, Traberg HA, et al. Phase II study on stereotactic body radiotherapy of colorectal metastases. Acta Oncol 2006;45(7):823-30.
- Jiang HC, Liu LX, Piao DX, et al. Clinical short-term results of radiofrequency ablation in liver cancers. World J Gastroenterol 2002;8:624-30.
- Johnson LB, Krebs TL, Van Echo D, et al. Cytoablative therapy with combined resection and cryosurgery for limited bilobar hepatic colorectal metastases. Am J Surg. 1997 Dec;174(6):610-3.
- Katz AW, Carey-Sampson M, Muhs AG, et al. Hypofractionated stereotactic body radiation therapy (SBRT) for limited hepatic metastases. Int J Radiat Oncol Biol Phys 2007 Mar 1;67(3):793-8.
- Kavanagh BD, McGarry RC, Timmerman RD. Extracranial radiosurgery (stereotactic body radiation therapy) for oligometastases. Semin Radiat Oncol 2006 Apr;16(2):77-84.
- Kim MS, Kang JK, Cho CK, et al. Three-fraction stereotactic body radiation therapy for isolated liver recurrence from colorectal cancer. Tumori. 2009 Jul-Aug;95(4):449-54.
- Kuvshinoff BW, Ota DM. Radiofrequency ablation of liver tumors: influence of technique and tumor size. Surgery. 2002 Oct;132(4):605-11; discussion 611-2.
- Lee MT, Kim JJ, Dinniwell R, et al. Phase I study of individualized stereotactic body radiotherapy of liver metastases. J Clin Oncol 2009 Apr 1;27(10):1585-91.
- Lencioni R, Crocetti L, Cioni D, et al. Percutaneous radiofrequency ablation of hepatic colorectal metastases: technique, indications, results, and new promises. Invest Radiol. 2004 Nov;39(11):689-97.
- Lencioni R, Donati F, Cioni D et al. Detection of colorectal liver metastases: prospective comparison of unenhanced and ferumoxides-enhanced magnetic resonance imaging at 1.5 T, dual-phase spiral CT, and spiral CT during arterial portography. MAGMA 1998;7:76-87.
- Livraghi T, Meloni F, Solbiati L, et al; Collaborative Italian Group using AMICA system. Complications of microwave ablation for liver tumors: results of a multicenter study. Cardiovasc Intervent Radiol. 2012 Aug;35(4):868-74.
- McGahan JP, Browning PD, Brock JM, et al. Hepatic ablation using radiofrequency electrocautery. Invest Radiol 1990;25:267-70.
- McGinn CJ, Ten Haken RK, Ensminger WD, et al. Treatment of intrahepatic cancers with radiation doses based on a normal tissue complication probability model. J Clin Oncol 1998 Jun;16(6):2246-52.
- Mendez Romero A, Wunderink W, Hussain SM, et al. Stereotactic body radiation therapy for primary and metastatic liver tumors: A single institution phase i-ii study. Acta Oncol 2006;45(7):831-7.
- Mulier S, Mulier P, Ni Y, et al. Complications of radiofrequency coagulation of liver tumours. Br J Surg 2002;89:1206-22.
- Oshowo A, Gillams A, Harrison E, et al. Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg. 2003 Oct;90(10):1240-3.
- Pathak S, Jones R, Tang JM, et al. Ablative therapies for colorectal liver metastases: a systematic review. Colorectal Dis. 2011 Sep;13(9):e252-65.
- Rothbarth J, Pijl ME, Vahrmeijer AL, et al. Isolated hepatic perfusion with high-dose melphalan for the treatment of colorectal metastasis confined to the liver. Br J Surg 2003;90:1391-7.
- Ruers T, Punt C, Van Coevorden F, et al; EORTC Gastro-Intestinal Tract Cancer Group, Arbeitsgruppe Lebermetastasen und?tumoren in der Chirurgischen Arbeitsgemeinschaft Onkologie (ALM-CAO) and the National Cancer Research Institute Colorectal Clinical Study Group (NCRI CCSG). Radiofrequency ablation combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phase II study (EORTC 40004). Ann Oncol. 2012 Oct;23(10):2619-26.
- Rule W, Timmerman R, Tong L, et al. Phase I Dose-Escalation Study of Stereotactic Body Radiotherapy in Patients With Hepatic Metastases. Ann Surg Oncol. 2011 Apr;18(4):1081-7. doi: 10.1245/s10434-010-1405-5. Epub 2010 Nov 3.
- Rusthoven KE, Kavanagh BD, Cardenes H, et al. Multi-institutional phase I/II trial of stereotactic body radiation therapy for liver metastases. J Clin Oncol 2009 Apr 1;27(10):1572-8.
- Schefter TE, Kavanagh BD, Timmerman RD, et al. A phase I trial of stereotactic body radiation therapy (SBRT) for liver metastases. Int J Radiat Oncol Biol Phys 2005 Aug 1;62(5):1371-8.
- Seifert JK, Morris DL. Prognostic factors after cryotherapy for hepatic metastases from colorectal cancer. Ann Surg 1998; 228:201-8.
- Solbiati L, Ierace T, Goldberg SN, et al. Percutaneous US-guided radio-frequency tissue ablation of liver metastases: treatment and follow-up in 16 patients. Radiology. 1997 Jan;202(1):195-203.
- Solbiati L, Ierace T, Tonolini M, et al. Radiofrequency thermal ablation of hepatic metastases. Eur J Ultrasound 2001;13:149-158.
- Solbiati L, Ierace T, Tonolini M. Long-term survival of patients treated with radiofrequency ablation for liver colorectal metastases: improved outcome with increasing experience. Radiology 2003 S;229,:411.
- Solbiati L, Livraghi T, Goldberg SN, et al. Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology. 2001 Oct;221(1):159-66.
- Stintzing S, Hoffmann RT, Heinemann V, et al. Frameless single-session robotic radiosurgery of liver metastases in colorectal cancer patients. Eur J Cancer 2010 Apr;46(6):1026-32.
- van Iersel LB, Koopman M, van de Velde CJ, et al. Management of isolated nonresectable liver metastases in colorectal cancer patients: a case-control study of isolated hepatic perfusion with melphalan versus systemic chemotherapy. Ann Oncol. 2010 Aug;21(8):1662-7. doi: 10.1093/annonc/mdp589. Epub 2010 Jan 28.
- Van Hazel G, Blackwell A, Anderson J, et al. Randomised Phase 2 Trial of SIR-Spheres1 Plus Fluorouracil/Leucovorin Chemotherapy Versus Fluorouracil/Leucovorin Chemotherapy Alone in Advanced Colorectal Cancer. J Surg Oncol. 2004 Nov 1;88(2):78-85.
- Van der Pool AE, Mendez RA, Wunderink W, et al. Stereotactic body radiation therapy for colorectal liver metastases. Br J Surg 2010 Mar;97(3):377-82.
- Vautravers-Dewas C, Dewas S, Bonodeau F, et al. Image-guided robotic stereotactic body radiation therapy for liver metastases: is there a dose response relationship? Int J Radiat Oncol Biol Phys. 2011 Nov 1;81(3):e39-47. doi: 10.1016/j.ijrobp.2010.12.047. Epub 2011 Mar 4.
- Verhoef C, de Wilt JH, Brunstein F, et al. Isolated hypoxic hepatic perfusion with retrograde outflow in patients with irresectable liver metastases; a new simplified technique in isolated hepatic perfusion. Ann Surg Oncol. 2008 May;15(5):1367-74. doi: 10.1245/s10434-007-9714-z. Epub 2008 Feb 1.
- Weng M, Zhang Y, Zhou D, et al. Radiofrequency ablation versus resection for colorectal cancer liver metastases: a meta-analysis. PLoS One. 2012;7(9):e45493.
- White TJ, Roy-Choudhury SH, Breen DJ, et al. Percutaneous radiofrequency ablation of colorectal hepatic metastases - initial experience. An adjunct technique to systemic chemotherapy for those with inoperable colorectal hepatic metastases. Dig Surg 2004;21:314-20.
- Wulf J, Guckenberger M, Haedinger U, et al. Stereotactic radiotherapy of primary liver cancer and hepatic metastases. Acta Oncol 2006;45(7):838-47.
- Méndez Romero A, Wunderink W, van Os RM, et al. Quality of life after stereotactic body radiation therapy for primary and metastatic liver tumors. Int J Radiat Oncol Biol Phys. 2008 Apr 1;70(5):1447-52. Epub 2007 Nov 8.